Wytyczne naukowe dotyczące danych wymaganych do oceny ryzyka środków aromatyzujących stosowanych w żywności lub na jej powierzchni
W Unii Europejskiej środki aromatyzujące podlegają rozporządzeniu (WE) nr 1334/2008 w sprawie środków aromatyzujących i niektórych składników żywności o właściwościach aromatyzujących do stosowania w żywności i na niej. Niniejsze rozporządzenie określa m. in. ogólne wymogi dotyczące bezpiecznego stosowania środków aromatyzujących i definiuje różne rodzaje środków aromatyzujących, wśród których określono następujące kategorie: substancje aromatyczne, preparaty aromatyczne, środki aromatyzujące z przetworzenia termicznego, prekursory środków aromatyzujących, inne środki aromatyzujące oraz materiały źródłowe. Określa również środki aromatyzujące, które wymagają oceny i zatwierdzenia.
Środki aromatyzujące, dla których wymagana jest ocena i zatwierdzenie, są wymienione w art. 9 lit. a)–f) rozporządzenia (WE) nr 1334/2008. Chociaż rozporządzenie (WE) nr 1334/2008 określa środki aromatyzujące, dla których ocena i zatwierdzenie przed wprowadzeniem do obrotu nie są wymagane zgodnie z jego art. Organ (EFSA) może również zostać poproszony o ocenę tych środków aromatyzujących.
Charakterystkę opisuje rozdział 1 artykułu EFSA Journal.
Informacje o istniejących ocenach innych organów regulacyjnych
W odniesieniu do środka aromatyzującego należy podać informacje na temat wszelkich istniejących ocen i zezwoleń. Powinno to obejmować szczegółowe informacje na temat organu, który przeprowadził ocenę i kiedy została ona przeprowadzona. Wszelkie istotne dane/badania wygenerowane/przeprowadzone w kontekście innych ram regulacyjnych powinny zostać przedstawione w całości, w tym szczegóły oceny, z których można wyprowadzić punkty odniesienia i/lub wartości orientacyjne dotyczące zdrowia.
Proponowane zastosowania i ocena narażenia
Dane potrzebne do oceny narażenia z dietą na środki aromatyzujące
Jak opisano w zakresie wymagań i obowiązków, niniejsze wytyczne dotyczą wniosków dotyczących nowych środków aromatyzujących do żywności (tj. substancji aromatycznych, preparatów aromatyzujących, środków aromatyzujących z obróbki termicznej, prekursorów środków aromatyzujących i innych środków aromatyzujących) oraz materiałów źródłowych, a także modyfikacji już dopuszczonych środków aromatyzujących do żywności. Dane potrzebne do oceny (potencjalnego) narażenia z dietą na wszystkie rodzaje środków aromatyzujących opisano poniżej.
Aby ocenić narażenie z dietą na nowy środek aromatyzujący, wnioskodawcy powinni przedstawić proponowane maksymalne poziomy stosowania dla każdej kategorii żywności, dla której występuje się o zezwolenie. Kategorie żywności należy wybrać spośród kategorii wymienionych w części D załącznika II do rozporządzenia (WE) nr 1333/2008, jak przewidziano w rozporządzeniu nr 1334/2008. Ponadto zachęca się wnioskodawców do podania typowych poziomów stosowania dla każdej kategorii żywności. Typowe poziomy stosowania to oczekiwane poziomy stosowania środka aromatyzującego w żywności.
Zachęca się również wnioskodawców do korzystania z kategorii żywności systemu klasyfikacji żywności FoodEx2 dla wszystkich przewidzianych poziomów stosowania. FoodEx2 to ustandaryzowany system klasyfikacji i opisu żywności opracowany przez EFSA, który ułatwia lepsze mapowanie poziomów stosowania odpowiedniej żywności niż w oparciu o (szerokie) kategorie żywności w części D załącznika II do rozporządzenia (WE) nr 1333/2008.
Podanie typowych poziomów stosowania i stosowanie kategorii żywności systemu klasyfikacji żywności FoodEx2 nie jest obowiązkowe; informacje te dadzą jednak EFSA możliwość doprecyzowania szacunków narażenia. Dostępne jest powiązanie między kategoriami żywności w części D załącznika II do rozporządzenia (WE) nr 1333/2008 a warunkami podstawowymi FoodEx2. Terminy podstawowe FoodEx2 są czasami niewystarczająco szczegółowe, aby powiązać je z kategoriami żywności w części D załącznika II do rozporządzenia (WE) nr 1333/2008, a zatem dodatkowe informacje zawarte w FoodEx2 (np. w powyższym łączu) mogą być wykorzystane przez EFSA w ocenie narażenia.
Kategorie żywności, w których dozwolone są środki aromatyzujące, są zwykle bardzo szerokie. W celu ograniczenia możliwego przeszacowania narażenia z dietą proponowane maksymalne i typowe poziomy stosowania powinny być najlepiej określone dla określonej żywności w kategorii żywności, w której środek aromatyzujący ma być stosowany. W tym celu należy zastosować system klasyfikacji FoodEx2. Im bardziej szczegółowe są informacje na temat żywności, w której można stosować środek aromatyzujący, tym dokładniejsze będzie oszacowanie narażenia z dietą.
W przypadku żywności wieloskładnikowej, tj. żywności przetworzonej należącej do kategorii żywności 18 w części D załącznika II do rozporządzenia (WE) nr 1333/2008, zawierającej składniki, w których zamierzone jest użycie środka aromatyzującego, należy podać poziomy stosowania dla każdego składnika (na poziomie nazwy żywności). Dla oceny narażenia z dietą byłoby korzystne określenie również ilości składników w złożonej żywności zawierającej środek aromatyzujący.
W przypadku modyfikacji istniejących zezwoleń, które pociągałyby za sobą zmiany warunków stosowania już dozwolonych środków aromatyzujących do żywności, tj. tych, których stosowanie jest obecnie ograniczone, wnioskodawcy powinni przedstawić te same informacje, co opisano powyżej.
Informacje, które należy podać w przypadku stosowania środków aromatyzujących do celów innych niż stosowanie jako środek aromatyzujący
Oprócz dodawania do żywności jako środek aromatyzujący, środki aromatyzujące mogą również np. być (i) naturalnie obecne w żywności, (ii) obecne, ponieważ są dodawane do żywności jako dodatek do żywności lub składnik żywności lub (iii) obecne w związku z ich zastosowaniem w materiałów mających kontakt z żywnością lub środków ochrony roślin. W stosownych przypadkach wnioskodawcy powinni przedstawić informacje jakościowe i, jeśli to możliwe, ilościowe na temat różnych dietetycznych źródeł środka aromatyzującego, którego dotyczy wniosek o zezwolenie. W tym celu można wziąć pod uwagę dane z literatury (tj. podstawowe odniesienia oraz dostępne bazy danych, np. VCF).
Ocena narażenia
Ocena bezpieczeństwa substancji celowo dodawanych do żywności opiera się na danych dotyczących spożycia żywności z kompleksowej europejskiej bazy danych EFSA dotyczącej spożycia żywności (kompleksowa baza danych). Dane te obejmują wiele krajów UE i następujące grupy ludności: niemowlęta (od 16 tygodnia życia), małe dzieci (1–2 lata), dzieci (3–9 lat), młodzież (10–17 lat), dorośli (18–64 lata). roku życia) oraz osoby starsze (65 lat i więcej).
Jeżeli wymagane jest zezwolenie w przypadku preparatów do początkowego żywienia niemowląt, należy oszacować narażenie z dietą dla niemowląt w wieku poniżej 16 tygodni zgodnie z zaleceniem Komitetu Naukowego EFSA (Komitet Naukowy EFSA, 2017a).
- Dla populacji ogólnej, w tym niemowląt od 16 tygodnia życia i małych dzieci.
Wnioskodawcy powinni przedstawić oszacowania narażenia z dietą na środek aromatyzujący za pomocą modelu spożycia dodatków do żywności (FAIM). Model ten wykorzystuje dane dotyczące spożycia żywności z kompleksowej bazy danych do oszacowania narażenia z dietą na podstawie maksymalnych lub typowych poziomów spożycia. Dane dotyczące spożycia są podzielone według kategorii żywności w części D załącznika II do rozporządzenia (WE) nr 1333/2008. Oczekuje się, że narzędzie to zawyży rzeczywiste narażenie z dietą na środki aromatyzujące, co będzie szczególnie widoczne, gdy środek aromatyzujący jest stosowany wyłącznie w określonej żywności należącej do kategorii żywności określonej w części D załącznika II do rozporządzenia (WE) nr 1333/2008.
Wnioskodawcy mają również dostęp do drugiego narzędzia służącego do szacowania narażenia z dietą, narzędzia DietEx. To narzędzie wykorzystuje te same dane dotyczące spożycia żywności, co FAIM, ale dane są kategoryzowane zgodnie z systemem klasyfikacji żywności FoodEx2. Ponieważ FoodEx2 zawiera więcej informacji na temat żywności zakodowanej w danych dotyczących spożycia żywności, to narzędzie może potencjalnie skutkować dokładniejszymi szacunkami narażenia z dietą. Zachęca się zatem wnioskodawców do korzystania z tego narzędzia również w celu oszacowania narażenia z dietą, ale nie jest to obowiązkowe.
Jeśli wnioskodawcy wymagają poziomu stosowania dla kategorii żywności, który nie jest dostępny w FAIM lub DietEx, powinni odnieść się do nadrzędnej kategorii żywności, tj. następnego wyższego poziomu zgodnie z hierarchią żywności. Ponadto poziom szczegółowości żywności, która może zawierać środek aromatyzujący, często nie będzie określony w tych narzędziach, w związku z czym maksymalne lub typowe poziomy stosowania zostaną przypisane do macierzystych kategorii żywności. W związku z tym oczekuje się, że szacunki narażenia z dietą dostarczone przez oba narzędzia zawyżą narażenie z dietą na środek aromatyzujący.
Narażenie z dietą zostanie oszacowane dla grup populacji wymienionych powyżej, jeśli zostanie to uznane za istotne. Rozważona zostanie również możliwość, że niektórzy konsumenci mogą być bardziej narażeni niż ogół społeczeństwa.
Ocena ryzyka będzie oparta na szacunkach narażenia z dietą dla konsumentów o wysokim narażeniu (szacowane narażenie na 95. percentyl) w odpowiednich grupach populacji i krajach UE, w oparciu o proponowane maksymalne poziomy stosowania obliczone za pomocą jednego lub obu narzędzi narażenia lub przy użyciu udoskonalonej oceny narażenia.
- Dla niemowląt poniżej 16 tygodnia życia
Do 16 tygodnia życia niemowlęta mają dietę składającą się głównie z mleka matki lub preparatów dla niemowląt. Aby ocenić bezpieczeństwo żywności spożywanej przez małe niemowlęta, EFSA wydała wytyczne dotyczące oceny ryzyka związanego z substancjami obecnymi w żywności przeznaczonej dla niemowląt poniżej 16 tygodnia życia (Komitet Naukowy EFSA, 2017a). Niniejsze wytyczne przedstawiają średnie i wysokie wartości spożycia preparatów do początkowego żywienia niemowląt (w mg/kg masy ciała (m.c.) dziennie) do oceny narażenia na substancje z dietą. Wartości 200 i 260 ml/kg mc./dobę jako zachowawcza średnia i wysoki poziom spożycia są zalecane dla substancji, które nie kumulują się w organizmie. Wartości te pochodzą z danych dla niemowląt w wieku 2–4 tygodni, kiedy spożycie mleka modyfikowanego jest największe, wyrażone w przeliczeniu na masę ciała. Zgodnie z wytycznymi dla substancji, dla których badania toksykokinetyczne wskazują na długi okres półtrwania i kumulację w organizmie, proponuje się wartości spożycia dla niemowląt w wieku około 2 miesięcy (56–83 dni), tj. około 170 (P50) lub 210 (P95) ml/kg mc dziennie.
Wnioskodawcy powinni stosować poziomy spożycia proponowane w wytycznych EFSA do obliczania narażenia z dietą na środek aromatyzujący dla niemowląt w wieku poniżej 16 tygodni, jeżeli jest on przeznaczony do stosowania w preparatach do początkowego żywienia niemowląt.
Ocena ostrego narażenia
W razie potrzeby EFSA może przeprowadzić ocenę ostrego narażenia z dietą na podstawie danych dotyczących toksyczności. Ostre narażenie będzie oceniane dla każdego dnia sprawozdawczego w kompleksowej bazie danych poprzez pomnożenie całkowitej dziennej ilości spożycia dla każdej odpowiedniej żywności przez maksymalny poziom wykorzystania dostępny dla tej żywności. Odpowiednie narażenia dla każdej odpowiedniej żywności spożytej w tym dniu (przez badanego) zostaną zsumowane i podzielone przez masę ciała danej osoby, aby oszacować narażenie w tym konkretnym dniu. Robiąc to dla wszystkich dni konsumpcji w bazie danych, generowany jest rozkład dziennych oszacowań ostrego narażenia. Na podstawie tych rozkładów zostanie obliczone wysokie (P95) ostre pobranie i wykorzystane w charakterystyce ryzyka.
Ocena ta zostanie przeprowadzona dla odpowiednich grup ludności i krajów UE obecnych w kompleksowej bazie danych.
W przypadku niemowląt poniżej 16 tygodnia życia, zważywszy, że jedynym w ich diecie pokarmem są preparaty dla niemowląt, 95. percentyl spożycia preparatów dla niemowląt na kg masy ciała należy uznać za maksymalną dzienną ilość spożywanego pokarmu. Ta wielkość spożycia zostanie pomnożona przez maksymalny poziom stosowania dostępny dla preparatów do początkowego żywienia niemowląt w celu oszacowania ostrego narażenia w tej grupie populacji.
Bezpieczeństwo
Należy przeprowadzić badania toksykologiczne środka aromatyzującego przeznaczonego do wprowadzenia do obrotu. W związku z tym, w zależności od rodzaju środka aromatyzującego przedłożonego do oceny, wnioskodawcy powinni przedłożyć dane wykazujące, że (i) badany materiał został wyprodukowany zgodnie z (a) procesem(-ami) produkcji opisanym w sekcjach 1.1.2 , 1.2.2 , 1.3 odpowiednio .2 , 1.4.2 , 1.5.2 , 1.6.2 ; (ii) spełnia dane dotyczące składu przedstawione w sekcjach 1.1.3 , 1.2.3 , 1.3.3 , 1.4.3 , 1.5.3 , 1.6.3odpowiednio; oraz (iii) jest zgodny ze specyfikacjami zaproponowanymi odpowiednio wsekcjach 1.1.6 , 1.2.6 , 1.3.6 , 1.4.6 , 1.5.6 , 1.6.5 . Ponieważ jest mało prawdopodobne, aby dostępne były odpowiednie dane dotyczące toksyczności u ludzi, in vivopotrzebne są badania na zwierzętach doświadczalnych w celu oceny możliwych zagrożeń dla ludzi wynikających ze spożycia środków aromatyzujących. Badania toksyczności należy generalnie prowadzić zgodnie z wytycznymi OECD. Jeżeli metoda badania zostanie uznana za konieczną lub użyteczną, dla której nie istnieje wytyczna OECD, może to być dopuszczalne w indywidualnych przypadkach, pod warunkiem że metoda ta opiera się na zatwierdzonym na szczeblu międzynarodowym protokole eksperymentalnym. W każdym przypadku wymagana jest deklaracja zgodności z dobrymi praktykami laboratoryjnymi (GLP) 22.
Strategia oceny bezpieczeństwa w odniesieniu do obecności małych cząstek, w tym nanocząstek
Komitet Naukowy EFSA opublikował Poradnik dotyczący wymogów technicznych dotyczących zastosowań produktów żywnościowych i paszowych podlegających regulacji w celu ustalenia obecności małych cząstek, w tym nanocząsteczek (Komitet Naukowy EFSA, 2021a).
Niniejsze wytyczne mają zastosowanie do wszystkich materiałów chemicznych, w tym środków aromatyzujących do żywności, które są wprowadzane do obrotu lub mają być wprowadzane do obrotu jako substancje lub mieszaniny, które mają zostać ocenione przez EFSA, w tym mieszanin i produktów wprowadzanych do obrotu jako preparaty płynne, chyba że informacje potwierdzają, że są to prawdziwe ciecze i nie zawierają małe cząsteczki w zawiesinie. W niniejszym dokumencie Komitet Naukowy ustanawia wymagania informacyjne dotyczące materiałów konwencjonalnych, które nie spełniają definicji opracowanego nanomateriału określonej w rozporządzeniu (UE) nr 2015/2283 w sprawie nowej żywności. 23Poradnik określa sposoby oceny (np. rozpuszczalność/rozpuszczanie/degradacja w wodzie; rozkład wielkości cząstek; stosowność badań bezpieczeństwa) w celu potwierdzenia, że ocena frakcji małych cząstek, w tym nanocząsteczek, nie jest potrzebna w przypadku proponowanego środka aromatyzującego do żywności lub że ta jest już objęty procesem oceny bezpieczeństwa zgodnie z konwencjonalnymi wytycznymi sektorowymi (tj. niniejszymi wytycznymi dotyczącymi środków aromatyzujących). Zgodnie z tymi wymogami technicznymi należy przedstawić dowody naukowe poparte danymi, potwierdzające, że:
- środek aromatyzujący spełnia kryteria rozpuszczalności lub szybkości rozpuszczania wskazane w sekcji 2 Komitetu Naukowego EFSA (2021a), lub
- środek aromatyzujący spełnia kryteria przesiewowe lub ilościowe dotyczące rozkładu wielkości cząstek wskazane w sekcji 3 Komitetu Naukowego EFSA (2021a), lub
- badania bezpieczeństwa przewidziane dla środka aromatyzującego są odpowiednie, aby zająć się bezpieczeństwem frakcji małych cząstek, w tym nanocząstek, zgodnie z zasadami wskazanymi w sekcji 4 Komitetu Naukowego EFSA (2021a).
Te wymagania w zakresie informacji obejmują uzupełniające ścieżki oceny i wystarczy wykazać, że środek aromatyzujący spełnia co najmniej jedno z kryteriów decyzyjnych wymienionych w tabeli 1 wytycznych Komitetu Naukowego EFSA. Niemniej jednak wnioskodawcy mogą przedłożyć informacje dotyczące więcej niż jednej ścieżki oceny (Komitet Naukowy EFSA, 2021a).
Jeżeli po uzyskaniu informacji nie można wykazać, że środek aromatyzujący spełnia co najmniej jedno z kryteriów decyzyjnych wymienionych w tabeli 1 wytycznych Komitetu Naukowego EFSA (Komitet Naukowy EFSA, 2021a), dane należy wygenerować z uwzględnieniem wymogów ustanowionych w Wytycznych Komitetu Naukowego EFSA dotyczących oceny ryzyka nanomateriałów (Komitet Naukowy EFSA, 2021b).
Toksyczność opisano w rozdziale 4.4. oraz 4.5.
Pełen artykuł dostępny na stronie EFSA.
Przeczytaj także
-
 28.12.2022
28.12.2022
EFSA: Rośnie liczba przypadków wysoce zjadliwej grypy ptaków u drobiu i ptaków wodnych
Czytaj więcejWedług najnowszego sprawozdania EFSA, Europejskiego Centrum ds. Zapobiegania i Kontroli Chorób (ECDC) oraz laboratorium referencyjnego UE (EURL) liczba przypadków wysoce zjadliwej grypy ptaków (HPAI) odnotowana w Europie wśród drobiu i ptaków wodnych…
-
 22.12.2022
22.12.2022
Opinia EFSA w sprawie ponownej oceny soli sodowej karboksymetylocelulozy (E466) jako dodatku do żywności w żywności dla niemowląt poniżej 16 tyg. życia
Czytaj więcejKarboksymetyloceluloza sodowa (E 466) została ponownie oceniona w 2018 r. przez były panel EFSA ds. dodatków do żywności i źródeł składników odżywczych dodawanych do żywności. W następstwie tej oceny panel ds. dodatków do żywności i środków aromatyzujących (FAF) został poproszony o ocenę bezpieczeństwa stosowania E 466 jako dodatku do żywności w żywności dla niemowląt w wieku poniżej 16 tygodni należących do kategorii żywności 13.1.5.1.
-
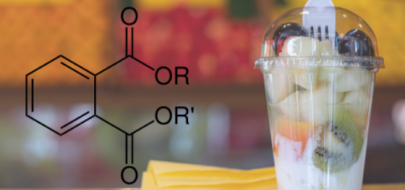 08.11.2021
08.11.2021
Ftalany – projekt opinii i protokołu narażenia skierowany do konsultacji społecznych
Czytaj więcejEFSA rozpoczęła konsultacje społeczne dotyczące opinii w sprawie identyfikacji i ustalania priorytetów oceny ryzyka plastyfikatorów stosowanych w materiałach przeznaczonych do kontaktu z żywnością oraz projektu protokołu oceny narażenia na substancje, którym nadano priorytet. Termin zgłaszania uwag upływa 16.12.2021 r.













.png)
