Bezpieczeństwo żywności zależy w dużej mierze od warunków higienicznych panujących w zakładach produkujących żywność. Obecność wysokich poziomów bakterii niepatogennych może mieć wpływ na trwałość i jakość artykułów żywnościowych przeznaczonych dla konsumentów. Równie ważna jest nieobecność w żywności patogenów (takich jak Salmonella i Listeria), które mogłyby potencjalnie wywołać chorobę. Producenci żywności muszą zatem w sposób sumienny, utrzymywać środowisko produkcyjne w czystości, aby uniknąć zanieczyszczenia krzyżowego produktu końcowego. Ale jak to się obecnie odbywa?
Kontrola wizualna
Mimo kilku zalet, kontrola wizualna ma również trochę ograniczeń. Ten sposób weryfikacji poprawności procesu czyszczenia jest subiektywny i niezbyt precyzyjny. Poza tym, nawet jeśli na powierzchni nie ma widocznych pozostałości, nie oznacza to, że jest ona nieskazitelna. Kontrola wizualna nie gwarantuje, że wszystkie pozostałości z poprzedniego cyklu produkcyjnego zostały w pełni usunięte lub że środek sanityzujący skutecznie zredukował poziom mikroorganizmów na powierzchni.
Metody oznaczania liczby drobnoustrojów na podłożu agarowym
Są to tradycyjne metody monitorowania higieny środowiska produkcyjnego. Metody pobierania wymazów zostały omówione w normie ISO 18593, "Mikrobiologia łańcucha żywnościowego - horyzontalne metody pobierania próbek z powierzchni", stanowiącej część Podręcznika analiz bakteriologicznych FDA oraz Przewodnika dla laboratoriów mikrobiologicznych USDA. Do wykrywania konkretnych organizmów można stosować zarówno podłoża nieselektywne, jak i selektywne. Ogólnie rzecz biorąc, istnieją dwa sposoby prowadzenia badań metodami opartymi na podłożu agarowym: bezpośrednie lub pośrednie. W przypadku metod bezpośrednich lub kontaktowych, płytki odciskowe umieszczane są na powierzchni, z której mają być pobrane próbki, a następnie są poddawane inkubacji. Pośrednie pobieranie próbek przeprowadzane jest za pomocą wymazówek, ściereczek lub gąbek, które następnie rozcieńcza się w roztworze buforowym i wykonuje posiew na płytki Petriego. Głównym ograniczeniem tych tradycyjnych metod wykrywania mikroorganizmów jest czas potrzebny na uzyskanie wyników. Ponadto, większość gatunków bakterii nie może być hodowana na podłożu agarowym, co jest zjawiskiem znanym jako wielka anomalia liczebności drobnoustrojów w technikach hodowlanych.
Wykrywanie ATP
Trójfosforan adenozyny (ATP) jest nukleotydem, który komórki wykorzystują jako koenzym do dostarczania energii. Można o nim myśleć jako o molekularnej "jednostce monetarnej" służącej do przenoszenia energii w obrębie wszystkich żywych komórek. Energia jest potrzebna do wszystkich czynności komórkowych, w tym do syntezy białek i błon, ruchu komórkowego i podziału komórek. Energia jest przekazywana, gdy ATP rozpada się na difosforan adenozyny i monofosforan adenozyny. Hydroliza kowalencyjnych połączeń fosforanów uwalnia energię, która jest wykorzystywana do reakcji. Komercyjne systemy testowe ATP wykorzystują reakcję lucyferyny/lucyferazy, która jest bardzo powszechna w przyrodzie, przy generowaniu światła widzialnego z energii dostarczanej przez ATP. Im więcej emitowanego światła, tym więcej ATP, co pośrednio może wskazywać na większą ilość mikroorganizmów lub pozostałości po żywności. Należy jednak pamiętać o jednym ważnym zastrzeżeniu: z racji tego, że systemy te są powszechnie stosowane do walidacji skuteczności procesu czyszczenia, częścią reakcji są również niekiedy środki dezynfekujące. Te środki dezynfekujące mogą naruszyć ściany komórkowe mikroorganizmów, jak również komórek pochodzenia roślinnego i zwierzęcego, ale zachowując ich ATP. Biorąc również pod uwagę, że największa część ATP na powierzchni jest pochodzenia zwierzęcego lub roślinnego, oznacza to, że nie ma rzeczywistej korelacji pomiędzy żywymi organizmami obecnymi na powierzchni a wynikami pomiaru ATP.
Metody ATP mają jeszcze jedną potencjalną wadę: różnią się pod względem możliwości zastosowania w zależności od rodzaju pozostałości po żywności. Dla przykładu - test ATP nie nadaje się do badania mąki pszennej, ponieważ jest ona wysoce przetworzoną matrycą z niewielką ilością ATP w swoich pozostałościach. Natomiast pozostałości po produktach mięsnych zawierają duże ilości ATP. Mimo że za pomocą systemów testowych ATP nie można policzyć żadnych bakterii, są one bardzo często stosowane, ponieważ wyniki są generowane w ciągu kilku sekund, czym nie może pochwalić się żadna z dotychczas stosowanych technologii.

Dlaczego więc nie możemy mieć wszystkiego? Święty Graal w zakresie weryfikacji czystości
Producenci żywności potrzebują szybkiej metody, która bezpośrednio określa ilość bakterii i cząsteczek i na którą nie mają wpływu środki dezynfekujące ani temperatura. Choć wydaje się to nieosiągalne, podstawowa technologia umożliwiająca realizację tego celu już istnieje i jest obecnie stosowana.
Przedstawiamy cytometrię przepływową
Cytometria przepływowa (FCM) odnosi się do grupy technik, które wykorzystują sygnały optyczne lub elektryczne do wykrywania i pomiaru pewnych fizycznych lub chemicznych właściwości komórek i cząsteczek zawieszonych w płynie. Prawie 300 badań [1] przeprowadzonych w latach 2000-2018 oceniło FCM jako narzędzie do charakterystyki mikrobiologicznej jakości wody. Badania te były w stanie zilustrować wartość FCM w uzdatnianiu, dystrybucji i ponownym wykorzystaniu wody. Obecnie istnieje szereg badań dokumentujących udane przypadki zastosowania FCM, na tyle wiarygodne, że można zaryzykować stwierdzenie, iż metoda ta mogłaby zostać w sposób racjonalny i realistyczny przyjęta jako rutynowa metoda oceny jakości wody.
Co to wszystko ma wspólnego z walidacją procesu czyszczenia w zakładach produkcji żywności? Metody wcześniej powszechnie stosowane w określaniu jakości wody były często ograniczone przez niską czułość, wysokie wymagania związane z czasem i nakładem pracy, podatność na interferencje ze strony związków hamujących oraz trudności w rozróżnianiu komórek żywotnych i nieżywotnych. (Wszystko to brzmi znajomo, prawda?) Ale uwaga: fluorescencyjne cytometry przepływowe to zazwyczaj nieporęczne, drogie urządzenia, a do ich obsługi konieczny jest wysoko wykwalifikowanego personel.
Wykorzystanie możliwości cytometrii przepływowej w urządzeniu przenośnym
Aby metoda FCM stała się realnym rozwiązaniem do weryfikacji procesu czyszczenia w zakładach przetwórstwa spożywczego, musi mieć prosty i łatwy w użyciu format przenośny, a jednocześnie na tyle dokładny, aby zapewnić wiarygodną liczbę bakterii i cząsteczek w próbkach środowiskowych. Stało się to możliwe dzięki zastosowaniu impedancyjnej cytometrii przepływowej. Impedancyjna cytometria przepływowa to konkretny rodzaj cytometrii przepływowej: zamiast systemów optycznych, takich jak technologia laserowa, impedancyjne cytometry przepływowe wykorzystują prąd zmienny o zmiennej częstotliwości, który umożliwia urządzeniu oddzielne wykrywanie i zliczanie komórek i cząsteczek . Podczas gdy cytometry przepływowe oparte na technologii optycznej są w stanie zliczyć jedynie komórki znakowane barwnikami, cytometry przepływowe impedancyjne mogą wykonać tę samą operację bez konieczności znakowania. W porównaniu z innymi urządzeniami do cytometrii przepływowej są one kompaktowe, przenośne i zasilane bateryjnie, co umożliwia stosowanie ich w miejscu pobrania próbki.
Jak działają impedancyjne cytometry przepływowe?
Impedancyjna cytometria przepływowa wykorzystuje unikalne właściwości elektro-magnetyczne błony komórkowej i cytoplazmy do odróżniania bakterii od innych cząsteczek .
Membrana i cytoplazma komórki wpływają na pole elektryczne w sposób odmienny niż inne cząsteczki w próbce. Przykład z wykorzystaniem cząsteczek metalicznych (przewodzących), cząsteczek nieprzewodzących i nieuszkodzonych komórek w najlepszy sposób ilustruje tę zasadę. Niezależnie od częstotliwości pola elektrycznego, przewodność cząsteczek metalicznych pozwala na jego niezakłócony przepływ.
Podobnie w drugą stronę; cząsteczki nieprzewodzące, takie jak polistyren, będą opierać się polu elektrycznemu; prąd będzie poruszać się tylko w cieczy, co prowadzi do wyraźnego przesunięcia objętości skorelowanego z rozmiarem cząsteczek w kuwecie przepływowej. Nieuszkodzone komórki są jednak wyjątkowe pod tym względem, że w zależności od częstotliwości pola elektrycznego przypominają jednocześnie cząsteczki nieprzewodzące i przewodzące. Przy niskich częstotliwościach, izolacyjna właściwość błony komórkowej uniemożliwia przenikanie pola elektrycznego, co prowadzi do tego samego rodzaju przemieszczenia, jak w przypadku cząsteczek nieprzewodzących. Przy wyższych częstotliwościach możliwe jest jednak częściowe przeniknięcie przez membranę; w tym przypadku komórki są podobne do cząsteczek metalicznych. Mikroelektrody w impedancyjnych cytometrach przepływowych generują pola zarówno przy niskich, jak i wysokich częstotliwościach, co pozwala urządzeniu wykryć te zmiany w przewodności i oporności oraz przypisać je w precyzyjnej liczbie do cząsteczek lub nieuszkodzonych komórek. Detektor identyfikuje cel jako bakterię w oparciu o zmienny stopień impedancji lub przewodności przy tych częstotliwościach. Użytkownik otrzymuje wtedy oddzielne zliczenia nieuszkodzonych komórek i cząsteczek.
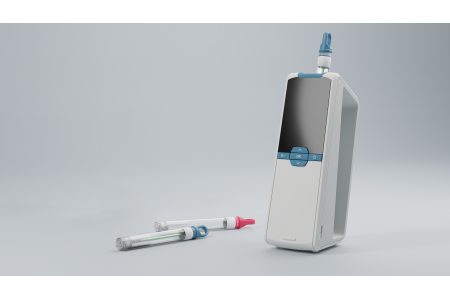
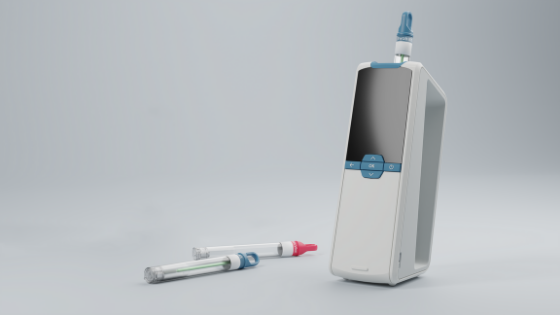
Zastosowanie impedancyjnej cytometrii przepływowej w kontekście bezpieczeństwa żywności: przedstawiamy CytoQuant®.
Jak wspomniano powyżej, jedną z zalet impedancyjnych cytometrów przepływowych w zestawieniu z innymi rodzajami urządzeń cytometrycznych jest ich przenośność. Lekkie, małe i zasilane bateriami, nadają się do pracy w terenie i w krytycznych punktach kontrolnych, gdzie higiena jest kwestią nadrzędną.
Opracowany przez Romer Labs® impedancyjny cytometr przepływowy CytoQuant® przeznaczony jest do stosowania właśnie w takich obszarach, w tym w zakładach produkcji żywności i pomieszczeniach czystych. Impedancyjna cytometria przepływowa przynosi znaczne korzyści producentom żywności, którzy chcą zweryfikować swoje programy bezpieczeństwa żywności i procesów czyszczenia: szybkie i oddzielne oznaczanie ilościowe bakterii i cząsteczek (które mogą służyć jako substrat do dalszego wzrostu bakterii), czułość metody oraz wytrzymałość zestawu do pobierania wymazów i samego cytometru.
System CytoQuant® jest łatwy w użyciu, ponieważ urządzenie wykonuje wszystkie czynności poza pobieraniem wymazów. Test rozpoczyna się od pobrania wymazu z uprzednio wybranego obszaru (20 x 20 cm) badanej powierzchni. Następnie wymazówka jest umieszczana w probówce zawierającej opatentowany roztwór przewodzący. Po potrząśnięciu probówką, w celu zawieszenia bakterii, należy umieścić ją w urządzeniu CytoQuant®. Dwie igły wnikają w dno probówki, łącząc ciecz z systemem przepływu w urządzeniu. Następnie, po wprowadzeniu roztworu do układu przepływowego, jest on przepuszczany przez elektrody w kuwecie przepływowej. CytoQuant® jest w stanie wykryć każdą pojedynczą, nieuszkodzoną komórkę, która przez niego przechodzi. Po 30 sekundach urządzenie rejestruje oddzielne wyniki dla bakterii i cząsteczek, a następnie wyświetla je na ekranie.
Rewolucja czy ewolucja?
Mobilny cytometr przepływowy CytoQuant® umożliwia natychmiastową, dokonywaną w miejscu pobrania próbki, weryfikację procedur mycia i dezynfekcji w zakładach produkcji żywności lub innych obszarach, gdzie higiena ma kluczowe znaczenie. Poprzez bezpośrednie oznaczanie ilościowe bakterii i pozostałości na powierzchniach, bez wpływu ze strony środków dezynfekujących lub temperatury, zapewnia znaczące korzyści w porównaniu z urządzeniami ATP, a 30-sekundowy czas oczekiwania na wynik sprawia, że stanowi doskonałe uzupełnienie programu utrzymania higieny w zakładzie. Biorąc pod uwagę ogromny potencjał impedancyjnej cytometrii przepływowej, może być ona traktowana na równi z typowymi metodami hodowli drobnoustrojów lub nawet je zastąpić, jako standard w weryfikacji procesów czyszczenia. Oznaczałoby to prawdziwą rewolucję w tej dziedzinie.
Chcesz dowiedzieć się więcej lub zamówić demonstrację produktu? Kliknij tutaj: https://www.romerlabs.com/pl/produkty/cytoquant-mobilna-cytometria-przeplywowa/
Źródła:
[1] https://www.sciencedirect.com/science/article/abs/pii/S0043135418310339
DOWIEDZ SIĘ WIĘCEJ:
-1.png)












-1.png)